آبکاری چیست؟
پوشاندن یک جسم با لایه ی نازکی از یک فلز با کمک یک سلول الکترولیتی را آبکاری نامیده می نامند.
جسمی که روکش فلزی بر روی آن ایجاد می شود باید رسانای جریان برق باشد.
الکترولیت مورد استفاده جهت آبکاری باید دارای یونهای آند فلزی باشد که قرار است لایه نازکی از آن روی جسم قرار بگیرند.
فرایند آبکاری اغلب با فلزات گرانبها چون طلا و نقره و کروم جهت افزایش ارزش فلزات پایه مانند آهن و مس و غیره و همچنین ایجاد روکشی بسیار مناسب (در حدود میکرومتر) برای استفاده از خواص فلزات روکش کاربرد دارد.
این خواص می تواند جلوگیری از خوردگی و رسانایی الکتریکی باشد.
کنش و واکنش هایی که بین فلزها و واسطه های محیطی صورت می گیرد موجب تجزیه و پوسیدگی آنها می شود چون فلزها میل بازگشت به ترکیبات ثابت را دارند.
پوسیدگی فلزات ممکن است به صورت شیمیایی(توسط گازهای خشک و محلولهای روغنی گازوئیل و نفت و مانند اینها) و یا الکتروشیمیایی (توسط اسیدها و بازها و نمک ها) انجام پذیرد.
طبیعت و میزان خوردگی یک فلز به محیط و حرارت وابسته است.
روشهای زیادی برای جلوگیری از خوردگی وجود دارد که یکی از متداول ترین راه ایجاد روکشی مناسب برای فلزها می باشد و معمول ترین روشهای روکش فلزها عبارتنداز:
رنگین کردن فلزات ٬ لعابکاری ٬ آبکاری با روکش پلاستیک٬ حفاظت کاتدیک و آبکاری با فلزات دیگر.

ابکاری
اصول آبکاری
در کل ترسیب فلز با استفاده از یک الکترولیت را می توان به صورت واکنش زیر نشان داد:
ـ فلز < (الکترون) z + کاتیون فلزی
ابکاری
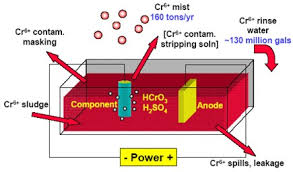
آبکاری الکتریکی
اصول و پایه آبکاری الکتریکی به این صورت است که در اثر عبور جریان مستقیم از یک الکترولیت فلز محلول در آن روی کاتد رسوب کرده و متعاقباً مقداری از فلز آند وارد محلول می شود به این ترتیب الکترولیت ثابت می ماند.
آبکاری الکتریکی جهت ایجاد پوشش های تزئینی و محافظ، اصلاح سطوح ساییده شده یا اضافه ماشینکاری شده، قطعه سازی یا به عبارتی شکل دهی الکتریکی قطعات شکل پیچیده که دارای ابعاد دقیق، زوایای مقعر و سطوح طرح دار هستند، عملیات آندکاری، پرداخت الکترولیتی، تمیزکاری الکترولیتی،اسید شویی آندی، استخراج و تصفیه فلزات به کار می رود.
در این روش ترسیب گالوانیک یک فلز بر پایه واکنشهای الکتروشیمیایی صورت می گیرد.
در هنگام الکترولیز در سطح محدود الکترود ,بر اثر واکنشهای الکتروشیمیایی الکترون ها یا دریافت می شوند (احیا) و یا واگذار می شوند (اکسیداسیون).
برای اینکه واکنشها در جهت واحد مورد نظر ادامه یابند لازم است به طور مداوم از منبع جریان خارجی استفاده شود.
واکنشهای مورد نظر در کاتد و آند همچنین در الکترولیت همیشه به صورت همزمان صورت می گیرند.
محلول الکترولیت باید حاوی یونهای فلز رسوب کننده باشد و چون یونهای فلزها دارای بار مثبت می باشند به دلیل جذب بارهای مخالف تمایل به حرکت در جهت الکترود یا قطبی که دارای الکترون اضافی می باشد (قطب منفی یا کاتد) را دارند.
قطب مثبت یا آند همان قطب مخالف است که کمبود الکترون دارد.
در کل سیکل معمول پوشش دهی را می توان به صورت زیر در نظر گرفت:
یک اتم در آند یک یا چند الکترون از دست می دهد در نتیجه محلول پوشش دهی به صورت یون مثبت در می آید.
یون مثبت به سمت کاتد یعنی محل تجمع الکترون ها جذب شده و در جهت آن حرکت می کند.
این یون الکترون های از دست داده را در کاتد به دست آورده و پس از تبدیل به اتم به صورت جزیی از فلز رسوب می کند.
- ابکاری
- ابکاری
- ابکاری نیکل
- ابکاری
- ابکاری
- ابکاری
قوانین فارادی
قوانین فارادی اساس آبکاری الکتریکی فلزها را تشکیل می دهند و نسبت بین مقدار عناصر جا به جا شده در الکترودها و انرژی الکتریکی را نشان می دهند.
قانون اول) مقدار موادی که بر روی یک الکترود ترسیب می شوند رابطه مستقیمی با مقدار الکتریسیته ای که از الکترولیت عبور می کنند دارند.
قانون دوم) مقدار مواد ترسیب شده با استفاده از الکترولیت های مختلف توسط مقدار الکتریسیته یکسان به صورت جرم هایی با اکی والان مساوی از آنهاست.






